熱とは物体を構成する原子や分子の力学的エネルギーである。
よって、エネルギーの高さを熱として感じたり、温度に表れたりするのである。
よって、熱や温度の変化を考える時はエネルギーの変化を考えることと同義である。
また、力学的エネルギー保存則と同様にエネルギー保存則が満たされるので、物質の温度を上げるために必要なエネルギー(熱量)である比熱もエネルギー保存則を考えれば良い。
本記事では、熱量と比熱について説明する。
熱と温度
熱と温度とは
物体の熱い冷たいという感覚は物体に熱があるかないか、つまり、温度が高いか低いかで決まる。
では、温度とは何で決まるのだろうか。
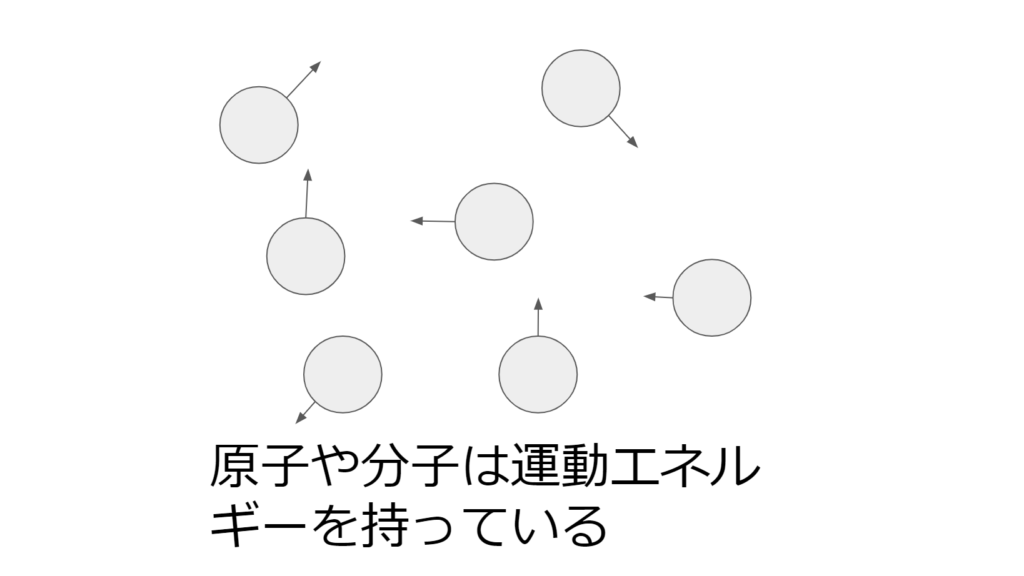
それは、物体を構成する原子や分子の運動エネルギー(熱量)で決まる。
どんな物体でも、小さいスケールで見ると原子や分子の集合である。
これらの原子や分子はじっと止まっているのではなく、乱雑に動いている。(熱運動)
つまり、原子や分子は運動エネルギーを持っている。
この運動エネルギーが高い状態が熱がある、又は温度が高いという状態である。
温度の表し方
温度の表し方には2種類ある。
セルシウス温度
1気圧下で氷が水になる温度から、水から水蒸気になる温度を100等分して、それぞれを0[℃]、100[℃]とした温度である。
下限は-273[℃]であり、上限は存在しない。
絶対温度
物体の原子や分子が力学的エネルギーを持たない状態を0[K]として、セルシウス温度と同じ目盛りで刻んだ温度である。
0[K]はセルシウス温度で表すと-273[℃]である。
熱の特徴
温度の異なる2物体を接触させると、温度が高い方から低い方へ熱量の移動が始まる。
この現象は2物体の温度が等しくなるまで続く(熱平衡)
この時、熱量が移動する前の2物体の熱量の総和\(Q_1+Q_2\)と熱量が移動した後の熱量の総和\(Q’_1+Q’_2\)は変化しない。(エネルギー保存則)
つまり、以下の等式が満たされる。
\begin{eqnarray}
Q_1+Q_2=Q’_1+Q’_2
\end{eqnarray}

比熱と熱容量
比熱
比熱とは単位質量あたりの物質の温度を1K上げるために必要な熱量(エネルギー)のことである。
例えば、質量\(m\)で比熱が\(c\)の物質の温度を\(\Delta T\)だけ変化させるために必要な熱量\(Q\)は以下になる。
\begin{eqnarray}
Q=mc\Delta T
\end{eqnarray}
比熱は主に物質(水、鉄etc)に対して用いる。
熱容量
熱容量とは、ある物体の温度を1K上げるのに必要な熱量のことである。
例えば、熱容量\(C\)の物体の温度を\(\Delta T\)だけ変化させるために必要な熱量\(Q\)は以下になる。
\begin{eqnarray}
Q=C\Delta T
\end{eqnarray}
熱容量は主に物体(100gの水、100gの鉄etc)に対して用いる。
物質の三態
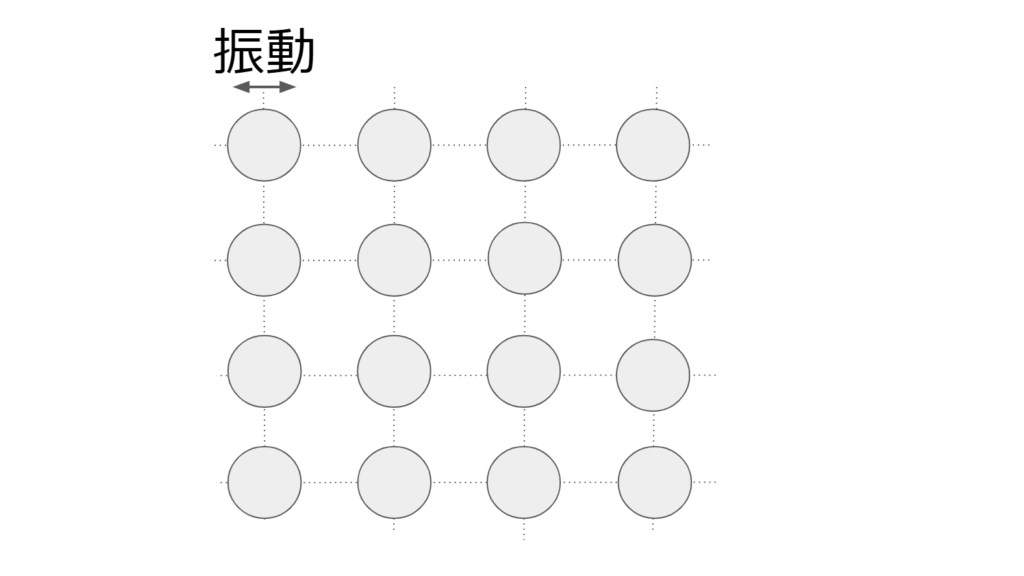
固体
固体は原子や分子が秩序を持ち、運動をしていない状態のことを言う。(その場で振動は続ける)
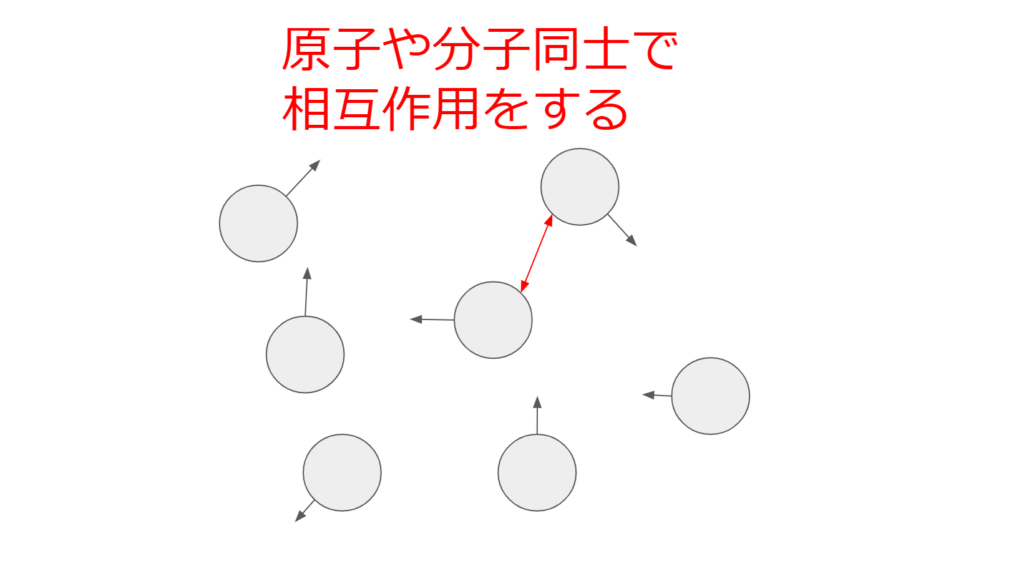
液体
液体は原子や分子が相互作用するものの、自由に動き回ることができる状態のことを言う。
また、固体から液体に状態変化する時に必要な熱量を融解熱と呼ぶ。
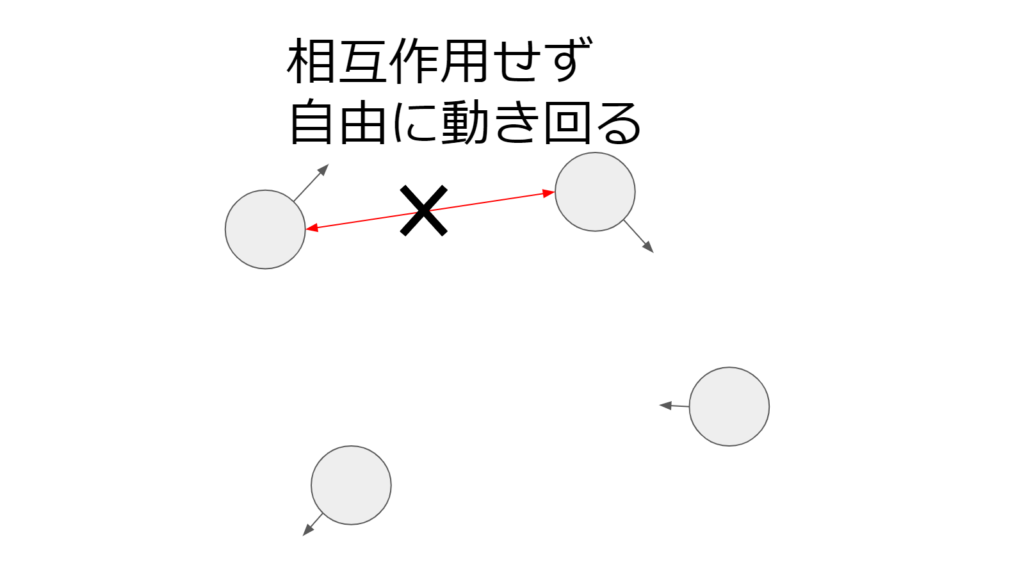
気体
気体は原子や分子は秩序を持たず、原子や分子は互いに縛られることなく自由に動き回ることができる状態のことを言う。
また、液体から気体に状態変化する時に必要な熱量のことを蒸発熱と呼ぶ。

